Лікар республиканського центру протезування суглобів
Діагностика асептичного розхитування компонентів ендопротеза кульшового суглоба в ранні терміни
Діагностика асептичного розхитування компонентів ендопротеза кульшового суглоба в ранні терміни.
Гайко Г.В. , Сулима О.М. , Підгаєцький В.М. , Гайко О.Г., Осадчук Т.І.
Україна м. Київ ДУ ІТО АМН України
ВСТУП
Основними методами діагностики асептичного розхитування компонентів ендопротеза дотепер є клінічні та рентгенологічні дослідження протезованого кульшового суглоба, за результатами яких розроблені покази до ревізійного протезування [1,2,3,4]. Але такі класичні рентгенологічні ознаки нестабільності, як просвітлення між компонентами ендопротеза та кістковим ложе, невідповідне положення компонентів протеза, можуть спостерігатися зразу і при наявності стабільного ендопротеза, і не супроводжується клінічними ознаками нестабільності. Це може бути пов’язано з порушенням техніки цементування або помилками в підборі за формою та розмірами безцементного ендопротеза. Тому, такі досить доказові рентгенологічні ознаки нестабільності не являються патогномонічними, досить часто не підтверджуються клінічними ознаками, не виявляються інтраопераційно і не є достовірним критерієм визначення показу до ревізійного протезування [5, 6, 7,8,9].
В той же час, такі явні ознаки нестабільності, як виражений больовий синдром, порушення функції суглоба, прогресуюче рентгенологічне просвітлення між компонентами ендопротеза та кістковим ложе, зміна позиції компонентів протеза та їх руйнуваня, з’являються лише після 3-5-ти років функціонування нестабільного ендопротеза [10,11,12]. Тому до 80 % пацієнтів звертаються за допомогою несвоєчасно, зі значними дефектами кісткової тканини протезованного кульшового суглоба, що значно ускладнює ревізійне протезування [13,14,15]. Виникає необхідність пластики дефектів, збільшується об'єм операції, тривалість відновного лікування та погіршуються результати ендопротезування хворих [16, 17].
Для діагностики нестабільності протеза досить широко застосовується артропневмографія, але метод інвазивний, доволі складний в виконанні, має протипокази. Є публікації щодо можливості діагностики нестабільності компонентів методом термографії [18]. Mulroy R.D.Jr., Harris W.H., в 1990 році методом подвійної фотонної абсорбциометрії на рентгенівському денситометрі визначили, що кістка після эндопротезування в процесі навантаження змінює свою щільність внаслідок втрати мінеральної складової [19]. Кістково-мозковий канал розширюється в середньому на 0,33 мм щороку, а товщина кортикального шару зменшується на 0,14 мм. Але рентгенівські денситометри не знайшли широкого використання в діагностиці асептичного розхитування компонентів ендопротеза.
Слід відмітити, що неінвазивні, сучасні методики діагностики асептичного розхитування компонентів ендопротеза на ранніх стадіях її розвитку розроблені не достатньо. Проблема залишається вельми актуальною.
Мета роботи - визначити ранні об’ективні ознаки асептичної нестабільності компонентів ендопротеза кульшового суглоба.
Матеріали та методи дослідження.
Використали новітні неінвазивні методи сонографії та рентгенденситометрії. Проведено дослідження у 90 хворих з одностороннім ендопротезуванням, оперованих в період з 1996 по 2006 роки в клініці ортопедії та травматології дорослих ІТО АМН України. Порівняли дані хворих, на різних стадіях розвитку нестабільності, співставили зі здоровим суглобом, стабільним протезом.
Перша група (30 хворих) - з явними клінічними та рентгенологічними ознаками нестабільності компонентів ендопротеза, наявністю кісткових дефектів.
Друга група (30 хворих) – з клінічними ознаками нестабільності (болі в протезованому суглобі та порушення функції), при відсутності рентгенологічних ознак нестабільності і дефектів кісткових лож, але доведеною нестабільністю під час ревізійного протезування.
Третя група (30 хворих), контрольна, з відсутністю клінічних та рентгенологічних ознак нестабільності ендопротеза.
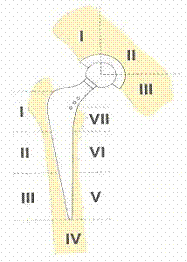
Ознаки нестабільності компонентів ендопротеза за рентгенологічними показниками визначали за схемою зон демаркації за Gruen та De Lee and Charnley (зони лізісу кісткової тканини між протезом та кістковим ложе).
Щільність кісткової тканини рентгенденситометрично вивчали в зонах De Lee and Charnley (западина1-3) та Gruen (ніжка 1-7). Дослідження проводили за допомогою рентгенівського денситометра ,,IDXA” виробництва фірми Lunar Corp., Madison. WI (США). Принцип роботи двоенергетичного рентгеноденситометра базується на роздільних вимірах енергії рентгенівського випромінювання при проходженні його через кісткову та м’які тканини [17]. Різниця ослаблення дозволяє методом математичного аналізу оцінити масу кісткового мінералу в досліджуваній ділянці. Перевагою даного методу є неінвазивність, висока точність (0,5 %), висока розподільча здатність (500 мікрон), низька доза опромінення (для проведення подвійного аналізу стегна (0.00146 мЗв), висока швидкість обстеження (60 сек.), автоматичний аналіз результатів [18,19].
Сонографічне дослідження проводили за допомогою ультразвукового апарату Simens Sonoline G-50 с лінійним датчиком 3-7,5мГц.
Оцінювали наявність рідини інтраартикулярно, її об’єм, розміри порожнини, яка вміщує рідину, ехогенність вмісту, наявність включень. Також проводили функціональну пробу на стабільність компонентів ендопротеза. Хворий під час дослідження згинав ногу в кульшовому суглобі до кута 90 гр. та максимально відводив її.
Результати та їх обговорення.
З метою визначення ранніх, ознак дестабілізації ендопротеза вивчили щільності кістки кульшового суглоба. Окремо визначали щільність кісткової тканини западини та проксимального відділу стегна хворих з нестабільними компонентами, порівнювали її з відповідними показниками здорової кінцівки, та кісткою пацієнтів з стабільними компонентами протезів[8].
Рис 1.Зони за De Lee and Charnley (западина 1-3) та Gruen (ніжка 1-7).
 Щільність кісткової тканини в зоні 1 за De Lee and Charnley вертлюгової западини на здорові стороні, без ендопротеза, була в середньому 1631 г/см2. У хворих контрольної, третьої групи, з стабільними протезами мінеральна щільність кісткової тканини (МЩКТ) дещо менша, але показники перевищують в середньому поріг в 1575 г/см2. Різниця незначна, не достовірна. Показники мінеральної щільністі кістки у хворих першої групи, з нестабільним протезом достовірно менша, не перевищує в середньому 1268 г/см2. Має місце значна, достовірна різниця щільності кісткової тканини вертлюгової западини у хворих третьої групи, з стабільним протезом в порівнянні з показниками хворих першої групи, з наявними дестабілізованими компонентами (368 г/см2).
Щільність кісткової тканини в зоні 1 за De Lee and Charnley вертлюгової западини на здорові стороні, без ендопротеза, була в середньому 1631 г/см2. У хворих контрольної, третьої групи, з стабільними протезами мінеральна щільність кісткової тканини (МЩКТ) дещо менша, але показники перевищують в середньому поріг в 1575 г/см2. Різниця незначна, не достовірна. Показники мінеральної щільністі кістки у хворих першої групи, з нестабільним протезом достовірно менша, не перевищує в середньому 1268 г/см2. Має місце значна, достовірна різниця щільності кісткової тканини вертлюгової западини у хворих третьої групи, з стабільним протезом в порівнянні з показниками хворих першої групи, з наявними дестабілізованими компонентами (368 г/см2).
У хворих другої групи, з клінічними ознаками нестабільності, але без рентгенологічних ознак теж можна прослідити значне зменшення щільності кістки, в середньому - 1285 г/см2, що значно відрізняється від показників здорового суглоба та суглоба хворих третьої групи, з стабільним компонентом ендопротеза (p< 0.05). Ренгенденситограми представлено на рисунку 2.
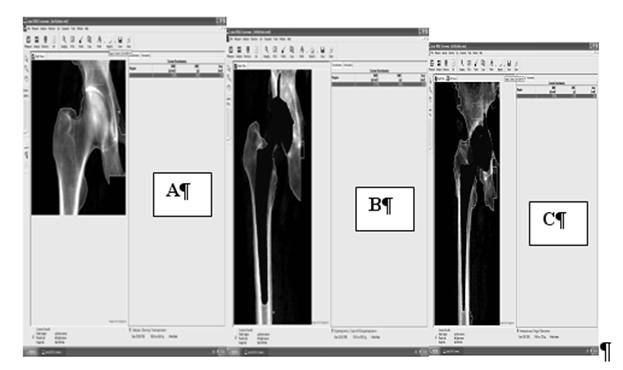
Рис.2-Рентгенівскі денситограми здорового суглоба (А), протезованого суглоба з стабільними компонентами (В) та з явними ознаками нестабільності (С).
Показники мінеральної щільності кісткової тканини западини представлено в таблиці 1.
Таблиця 1 − Показники мінеральної щільності кісткової тканини (МЩКТ) вертлюгової западини, зона 1за De Lee and Charnley BMD (г\см2) досліджених пацієнтів.
|
Групи хворих |
Середні показники МЩКТ зона 1 за De Lee and Charnley (оперована сторона), BMD (г\см2) |
Середній показники МЩКТ зона 1 за De Lee and Charnley (здорова сторона), BMD (г\см2) |
Різниця середніх показників |
|
Перша група
|
1268 ± 84 |
1631± 87 |
(p< 0.05) |
|
Друга група |
1285 ± 62 |
1631± 87 |
(p< 0.05) |
|
Третя група |
1575 ± 160 |
1631± 87 |
(p >0.05) |
Визначили зміни мінеральної щільності та появу зони розсмоктування, лізісу навколо нестабільної ніжки ендопротезу (або відсутність навколо стабільної) в першу чергу в зонах 1,7 та 4. Ми порівняли щільність кісткової тканини у хворих з клінічно стабільними та з явними клінічними ознаками нестабільності ніжки ендопротеза. Нам вдалося визначити деякі денситометричні закономірності стосовно стегнової кістки. Дані представлені в таблиці 2.
Таблиця 2 − Середні показники мінеральної щільності стегнової кістки на протезованій стороні в зонах 1,7 та 4 за Gruen, BMD (г\см2)
|
Зона дослідження, за Gruen |
Перша група Середні показники МЩКТ (г\см2) |
Друга група Середні показники МЩКТ (г\см2) |
Третя група Середні показники МЩКТ (г\см2) |
|
Зона 1,7 |
1099 ± 63 |
989 ± 97 |
1292 ± 85 |
|
Зона 4 |
2022 ± 114 |
2008 ± 77 |
1880 ± 122 |
|
Різниця середніх показників МЩКТ |
923
|
1019
|
588
|
Щільність здорової стегнової кістки в зоні 1.7 за Gruen - 1292 г\см2 в зоні 4 -1880 г\см2. Середні показники щільність її у хворих третьої групи, при наявності стабільної ніжки протеза абсолютно ідентичні показникам здорової кістки і складають в зоні 1.7 за Gruen - 1292 г\см2 в зоні 4-1880 г\см2. Щільність стегнової кістки у хворих першої групи, з явно нестабільними ніжками протезів, в проксимальному відділі, в зони 1.7 за Gruen значно зменшена, не досягає 1099 г\см2, а в зоні 4 значно збільшена до 2022 г\см2. Відповідні показники щільності достовірно відрізняються у хворих третьої та першої груп (p< 0.05). Тобто, стегнова кістка суттєво реагує на нестабільність зміною щільності кісткової тканини.
У хворих другої групи, з клінічними ознаками нестабільності, але без рентгенологічних її признаків, в проксимальному відділі, в зони 1.7 за Gruen середня щільність теж зменшена та складає - 989 г\см2, а в зоні 4 збільшується до 2008 г\см2. Таким чином відповідні середні показники щільності протезованої стегнової кістки хворих першої та другої групи достовірно не відрізняються (p >0.05), та достовірно відрізняються від показників щільності стегнової кістки хворих третьої групи та здорового кульшового суглоба (p< 0.05).
Тому патогномонічним симптомом нестабільності стегнового компоненту ендопротеза є саме збільшення різниці середніх показників щільності проксимального та дистального відділу стегнової кістки вдвічі.
У цих же хворих виконана сонографія, яка дозволила виявити запальну реакцію навколо ендопротеза, як ознаку його нестабільності
Сонографія давала можливість оцінити наявність інтраартикулярної рідини, її об’єм та розміри порожнини, зв’язок та розповсюдження по фасціальним проміжкам (сонограма №1 та 2).
Сонограма-1 Відсутність рідини та ознак гіперваскуляризації параартикулярних тканин, рухливості компонентів у хворого з стабільним ендопротезом.
![]()
![]()
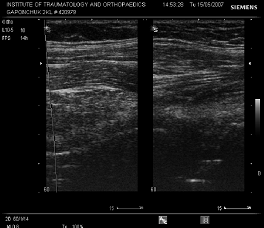
Рухливість компонентів ендопротеза виявлялась при виконанні функціональної проби. Ознаки гіперваскуляризації параартикулярних тканин при допплерографії давали можливість оцінити наявність та ступінь активності гранулематозного запалення навколо нестабільного ендопротеза, що є обьективним критерієм діагностики нестабільності компонентів ендопротеза.
Сонограма 2 Сонограма хворого з клінічними ознаками нестабільності. Ознаки гіперваскуляризації параартикулярних тканин та рухливості компонентів протеза, збільшення інтраартикулярної рідини.
![]()
![]()
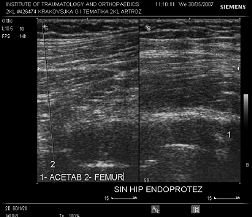
Результати дослідження представлені в таблиці 3.
Таблиця 3-Результати сонографічного дослідження кульшового суглоба протезованих хворих.
|
Категорії хворих |
Критерії діагностики нестабільності |
||
|
Середній об’єм навколопротезної рідини. |
Наявність ознак гіперваскуляризації |
Функціональна проба |
|
|
Перша група |
28.1 мл. ± 7.3мл. |
Наявні |
Позитивна |
|
Друга група |
20.4 мл. ± 4.6 мл. |
Наявні |
Негативна |
|
Третя група |
4.2 мл. ± 2.1мл. |
Відсутні |
Негативна |
У треті групі хворих, без клінічних та рентгенологічних ознак нестабільності виявлено відсутність порожнин навколо компонентів ендопротеза, незначну кількість перипротезної рідини (менше 5,0 мл. в середньому), та відсутність доплерографічних ознак гіперваскуляризації параартикулярних тканин. Функціональна проба на нестабільні компоненти протеза була негативною. Сонограма 1.
У перші групі обстежених, з клінічними ознаками нестабільності компонентів протезу в кульшових суглобах після єндопротезування відмічено збільшення об’єму інтраартикулярної рідини втричі у всіх випадках в порівнянні з третьою групою, без ознак нестабільності протезу (p< 0.05). Мали місце ознаки гіперваскуляризації параартикулярних тканин при допплерографії, що давало можливість діагностувати наявність запального процесу. Також при проведенні функціональної проби відмічалась рухливість компонентів ендопротеза. Сонограма 2.
У другі групі хворих, з больовим синдромом, без рентгенологічних ознак нестабільності, за відсутності дефектів кісткової тканини, не дивлячись на негативну функціональну пробу на нестабільність компонента, мали місце значне збільшення навколопротезної рідини (більше 20 мл.,p< 0.05) та були виражені ознаки гіперваскуляризації параартикулярних тканин при допплерографії.
ВИСНОВКИ
1 Асептична нестабільність компонентів ендопротеза, ще до появи класичних рентгенологічних признаків проявляється зменшенням щільності протезованої вертлюгової западини та проксимального відділу стегнової кістки, збільшенням середніх показників щільності дистального відділу протезованої стегнової кістки та збільшенням різниці середніх показників щільності між зонами 1,7 та 4 за Gruen
2. Гранулематозне запалення навколо нестабільного ендопротеза можливо діагностувати сонографічно на ранніх стадіях розвитку асептичної нестабільності протеза за гіперваскуляризацією тканин, та надлишковою кількістю навколопротезної рідини.
3. Сонографічні та рентгенденситометричні критерії діагностики нестабільності компонентів ендопротеза є новітніми та ранніми. Клінічні ознаки дестабілізації протеза, що підтверджуються сонографічно та рентгенометрично являються показом до своєчасного ревізійного ендопротезування, до виникнення значних дефектів кісткової тканини протезованого суглоба.
ПЕРЕЛІК ПОСИЛАНЬ
- Гайко Г. В., Поляченко Ю. В., Рибачук О. І. Стан та перспективи розвитку ендопротезування суглобів в Україні //Вісник ортопедії, травматології та протезування. – 2000. – № 2 (27). – С. 71 – 7
- Шерепо К. М. Асептическая нестабильность при тотальном эндопротезировании тазобедренного сустава (Эксперим. – морфол., биомехан. и клин. – стат. исслед.): Автореф. дис. ... д-ра мед. наук: 14.00.22 / ЦИТО. –М., 1990 – 49 с.
- Никифоров И.А. Принципи ревизионного ендопротезирования тазобедреного сустава //Ортопедия травматология и протезирование // — 1998. — N 3. — С. 73-78.
- Лоскутов О. Є., Нікіфоров І. О. Можливості ускладнення при тотальному ендопротезуванні // Ендопротезування суглобів (показання, техніка, помилки): Укр. наук. - прак. конф. (11 – 12 вересня 1997 м. Дніпропетровськ). – Київ - Дніпропетровськ, 1997. – С. 33 – 35.
- Рыбачук О. И. Ошибки и осложнения при тотальном эндопротезировании тазобедренного сустава // Ортоп., травматол. и протезир. – 1997. – № 2. – С. 13 – 19.
- Вакуленко В.М., Вакуленко А.В. Диагностика миграции вертлужного компонента эндопротеза тазобедренного сустава // Ортопед., травматол. и протезир. – 2002. - № 2 . – С. 78 – 81.
- Лучевая диагностика поздних осложнений при эндопротезировании тазобедренных суставов / Н.А. Данилова, А.П. Медведев, В.М. Машков, О.В. Куров // УІ сьезд травматологов и ортопедов России : Тез. докл. – Нижний Новгород, 1997. – С. 382 – 382. Крупаткин А.И., Балберкин А.В., Баранецкий А.Л.
- DeLee JS, Charnley J: Radiologic demarcation of cemented sockets in total hip replacement. Clin Orthop, 1976, 121, 20-32.
- Knobben B.A., Van Horn J.K., Vander Mej H.C., Busscher H.J. Evaluation of measures to decrease intra-operative bacterial contamination in orthopaedic implant surgery. // J.Hosp.Infect. - 2006.- 62(2):174-180.
- Harris W.H. Traumatic arthritis of the hip after dislocation and acetabular fractures: treatment by mold arthroplasty. An end-result study using a new method of result evaluation // J. Bone Joint Surg.-1969.- Vol.51-A.-june.-Pp.737-755
- Gustilo R.B.Pasternak H.S. Revision total hip arthroplasty wiht titanium ingrowth prosthesis and bone grafting for failed cemented femoral component loosening. Clin.Ortop.1988; 235:111-9
- Maloney WJ, Jasty M, Rosenberg A, et al: Bone lysis in wellfixed cemented femoral components. J Bone Joint Surg Br 1990;72:966-970.
- Anthony PP, Gie GA, Howie CR, et al: Localised endosteal bone lysis in relation to the femoral components of cemented total hip arthroplasties. J Bone Joint Surg Br 1990;72:971-979.
- Harris W.H., McCarthy J.C., O’Neill D.A. Femoral component loosening using contemporary techniques of femoral cement fixation // J. Bone and Joint Surg. – 1982. – V. 64-A. – P. 1063-1067.
- Kadoya Y., Kobayashi A., Ohashi H. Wear and osteolysis in total joint replacements // Acta orthop. Scand. – 1998. – V. 69, Suppl. 278. – 16 p.
- Capito C.P., Skoff H.D., Bohmer S.A. et al. Results and complications. Bone stock deficiency in total hip replacement: classification and management. - Slack, Thorofare. - New Jersey. - 1989. - P. 169.
- Convery F.R., Minter–Convery M. Acetabular augmentation in primary and revision total hip arthroplasty with cementless prosthesis. // Clin. Orthop. - 1998. - Vol. 252. - P. 167 - 175.
- Термографическая диагностика нестабильности эндопротезов крупных суставов с оценкой соматосимпатического вазомоторного рефлекса // Вестн. травматол. и ортопед. им. Н.Н. Приорова. – 2002. - № 4. – С. 59 – 60.
- Mulroy R.D.Jr., Harris W.H. The effect of imporved cementing techniques on component loosening in total hip replacement: an 11-year radiografic review. // J. Bone Joint Surg. - 1990. - Р. 727 - 757.
<>20.Шерепо Н.К., Шерепо К.М. Асептическая нестабильность протеза как основная проблема тотального эндопротезирования тазобедренного сустава: пути решения //Вестник травматол. и ортопед. им. Н.Н. Приорова. – 2007. - № 1. – С. 43 – 47.